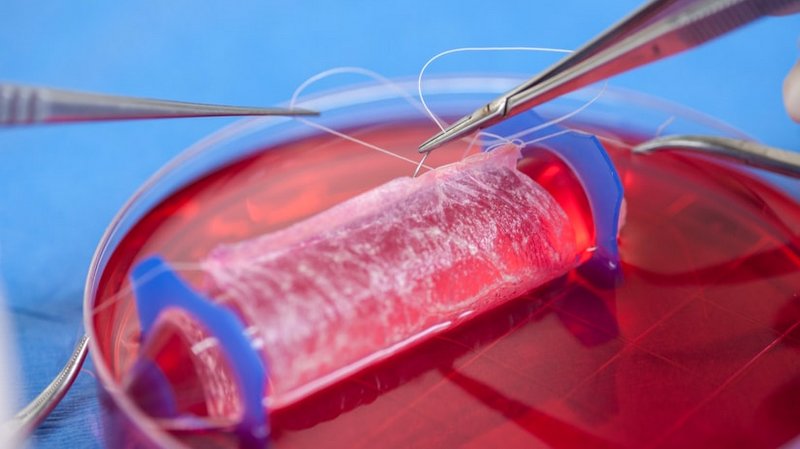
Doku mühendisliği veya rejeneratif tıp, hastalık veya travma gibi sebepler nedeniyle zarar görmüş doku ve organların tedavisine yönelik gelişen, laboratuvar ortamında geliştirilen dokuyu (veya organların) hastaya transfer etmek ya da zarar görmüş dokunun biyomalzemeler yardımıyla kendisini yenilemesini sağlamak temeli üzerine kurulmuş bir daldır. Doku mühendisliğinin en önemli özelliklerinden birisi, disiplinler arası çalışmaları neredeyse zorunlu kılmasıdır. Bu sebeple doku mühendisliği temel bilimler (biyoloji, kimya, fizik) tıp, mühendislik ve malzeme bilimi disiplinlerinin harmanlanmasıyla oluşmuş, hayli dinamik bir bilim dalı olarak öne çıkmaktadır.(1) Ayrıca kök hücre çalışmalarından da, kök hücrelerin programlanarak istenen doku özelliklerini göstermesinin sağlanması yoluyla, bu alana katkı yapılması amaçlanmaktadır.
Doku mühendisliğini, sadece doku ve organ yenilenmesi çerçevesinde değerlendirmek eksik bir tanım olabilir. Doku mühendisliğine yönelik geliştirilen biyolojik maddeler, aynı zamanda “ilaç taraması” (ilaçların klinik safhada denenmesi) süreçlerini kısaltmayı da hedeflemektedir. Şöyle ki: Eğer ki elimizde dokunun habitatını taklit edebildiğimiz bir maddemiz varsa, hayvan veya insanlar üzerinde denemeden önce elimizdeki madde üzerinde deneyebiliriz, ki özellikle ilacın toksik veya patojenik olup olmadığını değerlendirebiliriz. Bu, hem klinik safhasında ekonomik yükü azaltabileceği gibi, hem de ilaçların klinik deneme safhasına ulaşmasını hızlandırabilir. Tüm bu amaçlar oldukça heyecan verici de olsa, günümüzde pratiğe geçen uygulamalar henüz kısıtlı. Uygulamaların sınırlı kalmasının en önemli sebeplerinden birisi, doğal doku ortamına katkı sağlayan biyolojik etmenleri anlamadaki eksikliğimiz ve dolayısıyla geliştirilen maddelerin ve yöntemlerin ihtiyacı karşılayamaması. Bu sebeple, çalışmalar aynı zamanda hücrelerin, hücre dışı ortamla (hücre dışı matris) ve kendi aralarında nasıl etkileşimde oldukları, nasıl bölünüp, farklılaşıp, göç ettiklerini anlamak üzerine de kurulu. Her ne kadar bu zorluklar olsa da, bu terapilerin geleceğin ilaç endüstrisine yön vereceğinin işaretleri her geçen gün artmakta. Genel olarak bu terapileri, hangi yöntemlerin kullanıldığını, özellikle “doku iskelesi” olarak adlandırdığımız yapıları kısaca anlatmak istiyorum.

Doku mühendisliği yöntemlerine geçmeden önce, sıkça bahsedeceğim hücre dışı matris (ekstrasellüler matris, ECM) ile ilgili biraz bilgi vermek istiyorum. Hücre dışı matris, hücrenin dış ortamla bağlantısını sağlayan, hücreyi dış etmenlerden koruyan ve hücrenin diğer hücrelerle etkileşiminde rol oynayan, ayrıca hücreye gelen sinyallerin kontrol edildiği, yapısı hayli karmaşık şekerlerden ve proteinlerden oluşan bir yapıdır. Hücre dışı matrisin miktarı ve yapısı dokudan dokuya farklılık gösterir. Doku mühendisliğinde geliştirilmeye çalışılan yöntemler, genel olarak, hücre dışı matrisin yapısını, (biyolojik aktif maddeleri ve fiziksel yapısını) taklit etme amacını güder.
Bu alandaki yöntemlerin birisi, tüm organın alınarak, bazı kimyasal ve biyolojik yollarla hücrelerinden arındırılması, fakat hücre dışı matrisini koruyarak, hücre dışı matrisinin doğal “doku iskelesi” olarak kullanılmasından oluşmaktadır.(2) Böylece, doğal yollardan elde edilen bu doku iskelesi, hastadan izole edilen hücrelerle tekrar kültür edilerek, yani hücrelerin iskelete tutunması sağlanarak, istenilen dokuya dönüşmesine yardımcı olur. Bu yöntemin en önemli özelliği, laboratuvar ortamında geliştirilen bu organ, hastaya transfer edildiğinde, hastanın kendi hücreleri kullanıldığı için, bağışıklık sistemi tarafından ters tepki görme olasılığının oldukça düşük olmasıdır. Bu alandaki başarı hikâyelerine örnek olarak, 2008 yılında bir donörden alınan soluk borusunun hücrelerinden temizlenip, bronkomalazı hastası 30 yasındaki bir hastaya, hastanın kendi hücreleri kültür edilerek tekrar transfer edilmesi sonucu hastanın yaşam kalitesinin yükseltilmesini gösterebiliriz.(3, 4) Şimdiye kadar soluk borusu dışında, suni olarak üretilen mesane, kan damarları implantları başarılı bir şekilde gerçekleştirildi. Bu implantarın başarılı olmasının sebebi, hastaya aktarıldığı anda, hemen kan damalarıyla kontağa geçme gereksinmelerinin olmayışı. Daha karmaşık organların üretilmesi ise, mesela kalp, akciğer, karaciğer, daha karmaşık metotların bir araya getirilmesini gerektirmekte.
Doku iskelesi geliştirmenin diğer bir yöntemi de, biyobozunur maddeler kullanarak, hem fiziksel hem de biyolojik olarak hücre dışı matris özelikleri taşıyan biyolojik madde üretmektir. Bu maddeler, hücre dışı matrisin mekanik, fiziksel ve biyolojik özelliklerini taşımak zorundadır. Bu sebeple, biyomaddelerin fabrikasyonunda kullanılan iskele malzemesi maddeye gereken gücü ve esnekliği vermek zorunda olduğu gibi, hem de hücreyi belirli bir amaç için uyaracak biyo-aktif maddeleri belli bir zaman aralığına yayarak salabilecek kapasiteye sahip olmalıdır. Böylece, bu maddeler, hastaya implant edildiğinde zarar görmüş dokuyu onarabilecek fiziksel ve biyolojik özelliklere sahip olacaktır. Ya da, aynı yukarıdaki paragrafta anlatılan yöntem gibi, biyomalzeme hastanın kendi hücreleri kullanılarak istenilen organa dönüştürülüp, tekrar hastaya transfer edilecektir.(5) Bu alandaki gelişmelere örnek olarak, Zürih Üniversitesi biliminsanlarının ürettiği, içerisinde lenf bezi pleksusları barındıran deriyi gösterebiliriz. Bu amaçla, insan derisinden ayrıştırdıkları endotelyal hücre katmanını ve keratinocid hücrelerini, hücre dışı matris proteinlerinden oluşmuş yapay doku iskelesine yerleştirerek suni deri yapmayı başardılar ve ön-klinik aşamasında başarı sağladılar.(6)
Bu çeşit biyomalzeme alanının disiplinler arası olması hiç de şaşırtıcı değil: Biyomaddeyi sentez etmek için kimyaya, maddenin esnekliği için malzeme bilimine (veya makine mühendisliği), biyomaddedinin yapısını ve madde difüzyonunun hesaplanması için fiziğe ve biyolojik yapısının optimize edilmesi için de biyolojiye ihtiyaç duyulmaktadır. Bu alandaki bir diğer heyecan verici gelişme de, 3D yazıcılarda biyobozunur maddeler kullanılarak, kompleks doku yapılarının üretilmeye çalışılması. Bu konuda 3D yazıcıların vurgulanan özelliği, biyomaddelerin kontrollü ve diğer biyofabrikasyon yöntemlerine oranla, daha doğru ve hücre yapısına uygun şekilde üretilmesi.(7) Bu alanda heyecan verici uygulama olarak bronkomalazı sonucu solunum yolu çöken yeni doğan bir bebeğe, 3D yazıcı ile üretilen biyolojik olarak tekrar-emilebilir soluk borusu plağı implant edilmesi gösterilebilir.
Hangi kısmından bakarsanız bakın, biyomaddeler hem sağlık çalışanlarının, hem de pek çok alandan biliminsanlarının ortak bir amaç için çalıştıkları bir bilim dalı haline her geçen gün gelmekte ve diğer disiplinlerden biliminsanlarının da bu alana girmesi için teşvik etmekte. Umuyorum bu olumlu gelişmeler artan ivmeyle devam edecek ve sağlık kalitesinin yükseltimesinde önemli rol alacaktır.
Kaynaklar
1) Langer R, Vacanti JP, “Tissue Engineering”, Science 1993; 260:920-26
2) Badylak SF, Taylor D, Uygun K., “Whole-organ tissue engineering: decellularization and recellularization of three-dimensional matrix scaffolds”, Annu Rev Biomed Eng., 2011;13:27-53.
3) Harrison RH, St-Pierre J-P, Stevens MM., “Tissue Engineering and Regenerative Medicine: A Year in Review”, Tissue Engineering Part B: Reviews, 2014; 20:1-16
4) Macchiarini P, Jungebluth P, Go T, Asnaghi MA, Rees LE, Cogan TA, et al., “Clinical transplantation of a tissue-engineered airway”, Lancet 2008;372: 2023-30
5) Bajaj P, Schweller RM, Khademhosseini A, West JL, Bashir R., “3D Biofabrication Strategies for Tissue Engineering and Regenerative Medicine”, Annual Review of Biomedical Engineering, 2014; 16:247-76.
6) Marino D, Luginbuhl J, Scola S, Meuli M, Reichmann E., “Bioengineering dermo-epidermal skin grafts with blood and lymphatic capillaries”, Sci Transl Med., 2014; 6:221ra14.
7) Markstedt K, Mantas A, Tournier I, Martínez Ávila H, Hägg D, Gatenholm P., “3D Bioprinting Human Chondrocytes with Nanocellulose–Alginate Bioink for Cartilage Tissue Engineering Applications”, Biomacromolecules, 015;16:1489-96