Sonsuza kadar genç kalabilir miyiz, ya da kaybettiğimiz gençliği yeniden kazanabilir miyiz?
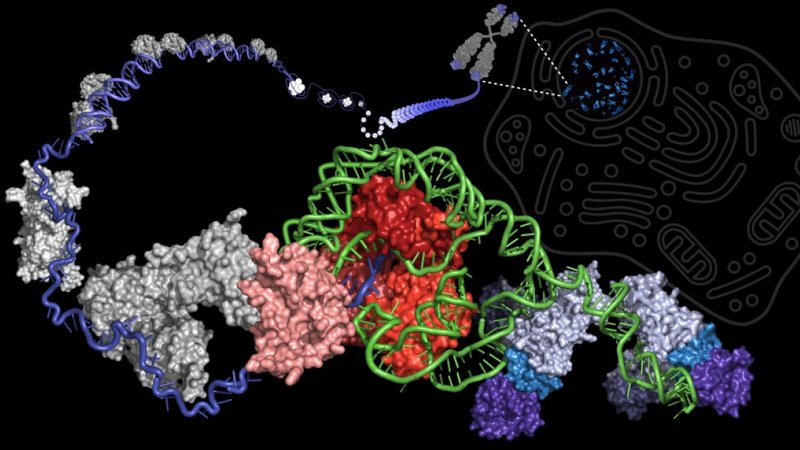
Yeni bir araştırma telomeraz enziminin katalitik döngüsünde önemli bir adımı ortaya çıkarmıştır. Bu katalitik döngü, insan telomeraz enziminin DNA sentezleme yeteneğini belirler.
Arizona Devlet Üniversitesi’ndeki Moleküler Bilimler Okulu’ndan Prof. Julian Chen’in laboratuvarında yapılan yeni bir araştırma, telomeraz enzimi katalitik döngüsünde önemli bir aşamayı ortaya çıkardı. Bu katalitik döngü, insan telomeraz enziminin, DNA “tekrarlarını” (altı nükleotidin spesifik DNA parçasını) kromozom uçlarına sentezleme kabiliyetini belirler ve böylece hücrelerdeki ölümsüzlüğü sağlar. Telomeraz hareketinin altında yatan mekanizmayı anlamak, etkili yaşlanma karşıtı tedaviler için yeni yollar sunacaktır.
Tipik insan hücreleri ölümlüdür ve sonsuza kadar kendilerini yenileyemez. Leonard Hayflick’in yarım asır önce gösterdiği gibi, insan hücreleri sınırlı bir replikasyon ömrüne sahiptir ve yaşlı hücreler bu sınıra genç hücrelerden daha çabuk ulaşır. Hücresel ömrün bu “Hayflick sınırı” genetik materyal taşıyan kromozomların uçlarında bulunan benzersiz DNA tekrarlarının sayısı ile doğrudan ilişkilidir. Bu DNA tekrarları, kromozomların uçlarını, genomu destabilize eden istenmeyen ve yersiz DNA düzenlemelerinden koruyan “telomer” olarak adlandırılan koruyucu başlık yapılarının bir parçasıdır.
Hücre her bölündüğü zaman, telomerik DNA kısalır ve sonuçta kromozom uçlarını sabit kalmaz. Telomer uzunluğunun bu sürekli kısalması, hücre büyümesinin sonuna kadar uzanan bir “moleküler saat” olarak işlev görür. Hücrelerin büyüme yeteneğinin azalması, zayıflık, hastalık ve organ yetmezliğine doğrudan katkıda bulunan azalmış hücre popülasyonu ve yaşlanma süreciyle güçlü bir şekilde ilişkilidir.
Moleküler düzeyde gençlik çeşmesi
Telomerin kısalması işlemine karşı koymak, hücresel yaşlanma sürecini geciktirmek ve hatta tersine çevirmek için anahtarı elinde tutan enzim ise telomerazdır. Telomeraz, telomerleri uzatarak hücresel yaşlanmayı dengeler; kaybedilen DNA tekrarlarını yeniden ekleyerek, moleküler saatteki gerisayıma zaman kazandırır ve bu şekilde hücrenin ömrünü etkili bir şekilde uzatır. Telomeraz, enzimin kendisinde bulunan bir RNA şablonunun kromozom uçlarındaki “GGTTAG” dizilimiyle, DNA’nın yapıtaşı olan altı nükleotidden oluşan çok kısa DNA tekrarını yeniden sentezleyerek telomerleri uzatır. Bununla birlikte, telomeraz enziminin aktivitesi, kayıp telomerik DNA tekrarlarını tamamen geri yüklemek ya da hücresel yaşlanmayı durdurmak için yetersizdir.
Telomerlerin kademeli olarak kısalması, hasarlı dokuları onaran hücreler ve/veya vücudumuzdaki yaşlanan organları yenileyen insan yetişkin kök hücrelerinin çoğalma kapasitesini etkilemektedir. Telomerazın yetişkin kök hücrelerindeki aktivitesi sadece moleküler saatin gerisayımını yavaşlatır ve bu hücreleri tamamen ölümsüzleştirmez. Bu nedenle yetişkin kök hücreler, telomer kısalması nedeniyle yaşlı bireylerde tükenir, bu da iyileşme sürelerinin uzamasına ve hücre popülasyonlarının yetersiz kalmasından kaynaklanan organ dokularındaki bozulmalara neden olur.
Telomerazın tüm potansiyeline dokunmak
Telomeraz enziminin düzenlenmesinin ve sınırlandırılmasının anlaşılması, telomer kısalmasını ve hücresel yaşlanmayı tersine çevirerek insan ömrünü uzatma ve yaşlı bireylerin sağlığını iyileştirme potansiyeline sahiptir. Chen Laboratuvarı’nın araştırmasında, Yinnan Chen, Joshua Podlevsky ve Dhenugen Logeswaran’ın çalışmalarıyla, kromozom uçlarındaki DNA tekrarlarının telomerik sentezi için telomerazın beceresini sınırlayan katalitik döngüdeki önemli bir adım ortaya çıkarıldı.
Prof. Chen, “Telomerazın doğru telomerik DNA tekrarlarının tam sentezini sağlamak için yerleşik bir fren sistemi vardır. Bu emniyetli fren de telomeraz enziminin genel aktivitesini sınırlıyor. Telomeraz enzimi üzerindeki frenleri düzgün bir şekilde serbest bırakmanın bir yolunu bulmak, yetişkin kök hücrelerinin kayıp telomer uzunluğunu geri yükleme ve hatta hücresel yaşlanmayı tersine çevirme potansiyeline sahiptir” diyor.
Telomerazın bu içsel freni, enzimin, “GGTTAG” dizisinin sonundaki DNA sentezini durdurması için, telomerazın kendi RNA şablonunda kodlanmış bir duraklama sinyalini işaret ediyor. Telomeraz bir sonraki DNA tekrarı için DNA sentezini yeniden başlattığında, bu duraklama sinyali hâlâ aktiftir ve DNA sentezini sınırlar. Özellikle, DNA tekrar sentezinin yeniden başlatılmasını önleyen duraklama sinyali hedeflenirse, telomeraz enzimatik fonksiyonu, telomer uzunluğunun kısaltılmasının daha iyi bertarafıyla, yaşlanan insan yetişkin kök hücrelerini canlandırma potansiyelini güçlendirebilir.
Diskeratozis congenita, aplastik anemi ve idiyopatik pulmoner fibroz içeren insan hastalıkları, genetik olarak, telomeraz aktivitesini olumsuz yönde etkileyen ve/veya telomer uzunluğunun kaybını hızlandıran mutasyonlara bağlanmıştır. Bu hızlanan telomer kısalması, artmış organ bozulmasıyla erken yaşlanmaya ve kritik derecede yetersiz hücre popülasyonlarının hasta ömrünü kısaltmasına çok benzer. Telomeraz aktivitesinin arttırılması, bu hastalıkların tedavisinde görünüşte en umut verici araçtır.
Telomeraz aktivitesinin artması, yaşlanan hücrelere gençliği verebilir ve erken yaşlanma benzeri hastalıkların tedavisini sağlayabilir; ama bu iyi aktivitenin çok fazlası da bireye zarar verebilir. Genç kök hücreler telomer uzunluğu kaybını telafi etmek için telomerazı kullanırken, kanser hücreleri de anormal ve tahrip edici büyümelerini sürdürmek için telomerazı kullanmaktadır. Telomeraz işlevinin arttırılması ve düzenlenmesi, hücre yenilenmesi ile kanser gelişimi için yüksek bir risk arasında dar bir çizgide yürünmesi gereken, hassas bir uygulamadır.
İnsan kök hücrelerinden farklı olarak, somatik hücreler insan vücudundaki hücrelerin büyük çoğunluğunu oluşturur ve telomeraz aktivitesinden yoksundurlar. İnsan somatik hücrelerinin telomeraz eksikliği, telomeraz kontrolsüz kanser hücresi büyümesini tetiklediği için kanser gelişim riskini azaltır. Bu nedenle, tüm hücre tiplerinde telomeraz aktivitesini ayrım gözetmeden artıracak ilaçlar arzu edilmez. Yeni keşif, telomeraz katalitik döngüsü açısından önemli bir yeni ilaç hedefi ortaya koymaktadır. Küçük moleküllü ilaçlar, kanser riskini arttırmadan yaşlanma karşıtı tedavilerin yapılabilmesinin yanı sıra, hastalık tedavisi için sadece kök hücreler içinde telomeraz etkinliğini artırmak için tasarlanabilir.