Çeviren: Semih İşbaş
Hücrelerin etrafındaki mikro çevre, hücrelerin birbirleriyle ve çevreleriyle nasıl etkileşime girdiğini belirler. Bu alanda, hücreler çeşitli moleküller aracılığıyla sürekli sinyaller gönderip alır. Bu sinyaller, hücrelerin büyümesini, bölünmesini, farklılaşmasını, hareket etmesini ve ölmesini kontrol eder. Hücreler ayrıca, hücre dışı veziküller adı verilen küçük kesecikler aracılığıyla da sinyal gönderebilir. Bu kesecikler, hücrenin içindeki proteinleri, lipidleri ve RNA’ları taşır ve başka hücrelere aktarabilir. Viral bir enfeksiyon sırasında, hücrelerin mikro çevresi değişir. Virüsler, hücreleri enfekte ederek onların genetik materyalini ve protein yapımını ele geçirir. Hücreler bunu fark ettiklerinde, enfeksiyona karşı savunma mekanizmalarını harekete geçirirler. Bu mekanizmalardan biri de, enfekte olmuş hücrelerin veya komşu hücrelerin salgıladığı interferon adı verilen bir sinyal molekülüdür. Interferonlar, virüsün yayılmasını önlemek için diğer hücreleri uyarır ve onların antiviral tepkilerini güçlendirir. Bu bağışıklık sinyal yolları, hastalığa neden olan birçok etken için iyi çalışılmış ve tanımlanmıştır. Bununla birlikte, viral enfeksiyon, viral hedeflere yardımcı olan başka mesajları da tetikler. Virüsler kendi replikasyonları için hücresel mekanizmaları ele geçirdikleri gibi, hücresel mikro çevrelerindeki antiviral savunmaları engellemek için hücreler arasındaki iletişimi de bozar ve birlikte seçerler.
Song ve arkadaşları, insan sitomegalovirüsü (HCMV) adlı bir virüsü model olarak kullanarak, virüsle enfekte olmuş hücrelerin yakınında bulunan enfekte olmamış hücreler üzerindeki derin etkilerini ortaya koyuyorlar. HCMV, herpesvirüs ailesine ait ve insanlarda yaygın olarak enfeksiyona neden olan bir virüstür. Tüm herpesvirüsler gibi, enfekte olan bireyde ömür boyu süren uyku (latent) bir enfeksiyon oluşturur2. HCMV enfeksiyonu genellikle belirgin bir hastalığa yol açmaz, ancak latent virüsün yeniden aktifleşmesi, bağışıklık sistemi zayıflamış kişilerde hayatı tehdit edebilir.
Laboratuvarda virüslerle ilgili çalışmalar yaparken, araştırmacılar genellikle virüsün hücreleri nasıl etkilediğini anlamaya çalışırlar. Bunun için, hücreleri virüsle enfekte ederler ve onların değişimlerini gözlemlerler. Ancak, hücreleri enfekte etmenin farklı yolları vardır. Bazı araştırmacılar, hücreleri çok yüksek miktarda virüsle aşılarlar. Bu şekilde, hemen hemen tüm hücreler aynı anda enfekte olur. Bu, araştırmacılara enfeksiyonun başlangıcından sonuna kadar olan süreci takip etme imkanı verir. Ayrıca, bu yöntemle elde edilen hücreler, birbirine çok benzer özelliklere sahip olur. Bu da, araştırmacıların sonuçlarını daha kolay yorumlamalarını sağlar.
Ancak, bu yöntem gerçek hayattaki durumu tam olarak yansıtmaz. Çünkü insanlarda virüs bulaşması daha yavaş ve daha seyrek olur. Virüs, vücutta sadece bazı hücreleri veya hücre gruplarını enfekte eder. Bu hücreler, çevrelerindeki enfekte olmamış dokularla etkileşim halindedir. Bu etkileşim, hem virüsün hem de bağışıklık sisteminin davranışını değiştirebilir. Bu nedenle, laboratuvarda her hücrenin enfekte olduğu viral aşılamalar kullanmak, bazen gerçekçi olmayan sonuçlar verebilir.
Enfekte olmamış hücreler, enfekte olmuş hücrelerden hangi sinyalleri alır ve nasıl tepki verir? Floresan etiketleme yöntemi kullanarak Song ve arkadaşları, viral enfeksiyon sırasında virüsün mikro çevresinin ve enfekte olmamış hücrelerin değişen davranışlarının karmaşık doğasını ortaya koymaya başlayan bir çalışma sunuyorlar.
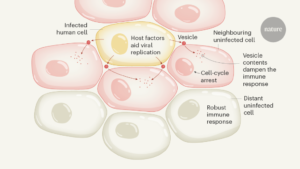
Yazarlar, fibroblast adı verilen bir tür insan hücresini kırmızı floresan protein (mCherry) ifade edecek şekilde tasarladılar ve bu protein hücreden salgılandı. Daha sonra hücreleri yeşil floresan proteini (GFP) ifade edecek şekilde tasarlanmış bir virüsle enfekte ettiler. Bu sayede, enfekte olmuş hücreler kırmızı ve yeşil renklerin karışımı olan sarı renkte görünüyor. Bu hücreler, etiketlenmemiş yani floresan protein üretmeyen ve enfekte olmamış hücrelerin olduğu kültür ortamına ekleniyor. Bu şekilde, enfekte olmuş hücrelerin çevresindeki enfekte olmamış hücreler oluşturuluyor. Bu ortak kültür sisteminde, enfekte olmuş hücrelerin komşuları, enfekte olmuş hücrelerin salgıladığı kırmızı floresan proteini alarak kendi içlerinde taşıyorlar. Bu da, enfekte olmuş hücrelerin komşu hücreleri nasıl etkilediğini görmek için kullanılabilecek bir işaretçi oluyor.
Floresanla aktive edilen hücre ayıklama sistemi kullanılarak üç hücre popülasyonu oluşturulmuştur. Bunlar enfekte olmuş hücreler (sarı), enfekte olmamış komşu hücreler (kırmızı) ve enfekte olmamış uzak hücrelerdi (floresan vermeyen). Daha sonra her bir hücre grubu, bu ortak kültür sisteminin bir parçası olmayan enfekte olmamış hücrelerden oluşan bir kontrol popülasyonundan ayıracak protein (proteomik) profillerini belirlemek için kütle spektroskopisi olarak bilinen bir yöntem kullanılarak analiz edildi.
Dikkat çekici bir şekilde, enfekte bir hücreye komşu olan enfekte olmamış hücreler, hem daha uzaktakilerden hem de enfekte hücrelerden farklı proteomik profillere sahipti. Viral genomları olmamasına rağmen, enfekte olmamış komşu hücreler HCMV proteinleri içeriyordu, bu da bu viral proteinlerin hücrenin viral enfeksiyonundan türetilmediğini gösteriyordu. Yazarlar, bu proteinlerin muhtemelen enfekte hücreler tarafından salınan hücre dışı veziküllerin içeriğinden türetildiğini göstermeye devam ettiler.
Proteomik profiller ayrıca komşu enfekte olmamış hücrelerin hücre döngüsü duraksadığını ve daha uzak enfekte olmamış hücrelere kıyasla bağışıklık tepkilerinin azaldığını göstermiştir. Biyolojik özelliklerdeki bu değişiklikler, enfekte hücrelerden hücre dışı veziküllerin üretilmesine ve salınmasına bağlıydı; bu da enfekte hücrelerden gelen sinyallerin yakın komşularını enfeksiyona hazırlamaya hizmet ettiğini gösteriyordu.
Song ve meslektaşları, enfekte olmuş hücrelere komşu olan enfekte olmamış hücreleri, grip veya uçuk virüsü gibi başka virüslerle enfekte etmişlerdir. Bu şekilde, komşu hücrelerin başka virüslere karşı duyarlılığını ölçmüşlerdir. Sonuç olarak, komşu hücrelerin başka virüslere daha kolay yakalandığını ve daha fazla hasar gördüğünü bulmuşlardır. Bu, komşu hücrelerin bağışıklık sisteminin zayıfladığını göstermektedir. Ancak, enfekte olmuş hücrelerden daha uzakta olan enfekte olmamış hücreler, başka virüslere karşı dirençli kalmıştır. Bu da, uzak hücrelerin virüsün varlığını fark edip savunma mekanizmalarını devreye soktuğunu göstermektedir.
Enfekte olmamış hücrelerin viral manipülasyonu, bağışıklık tepkilerini bozmak için mikroRNA (miRNA) adı verilen RNA’ları kullanan hepatit B virüsü ve enterovirüsler için daha önce tanımlanmıştır. Bu değişiklikler, enfekte olmamış hücrelerin viral giriş ve replikasyona karşı savunmasızlığının artmasıyla sonuçlanmaktadır3-5.
Song ve arkadaşları virüs mikroçevresinin inceliklerine cazip bir bakış sunmaktadır. Yakındaki hücreleri etiketleme yöntemine beş yıldan kısa bir süre önce öncülük edilmiştir6 ve virolojide kullanımı yeni bir gelişmedir. Bu çalışma, enfeksiyon için komşu hücrelerin viral olarak hazırlanmasının arkasındaki biyolojiyi ve spesifik viral proteinlerin ve miRNA’ların rollerini anlamak için daha derin mekanistik çalışmaların temelini oluşturmaktadır. Virüs mikroçevresinin tanımlanması, muhtemelen herpesvirüs latensi ve reaktivasyonunun yanı sıra sürekli viral replikasyon ve yayılmaya izin veren sonuçta ortaya çıkan değişiklikler dizisi hakkındaki anlayışımızı geliştirmeye yardımcı olacaktır.
Bir hücrenin çekirdeğinde bulunan hareketsiz, neredeyse ‘sessiz’ bir viral genomdan, yeni virüs partiküllerinin üretimiyle tamamlanan aktif bir enfeksiyonun varlığına giden adımlar, özellikle virüs mikroçevresinin rolü açısından tam olarak tanımlanmamıştır. Yeniden aktive olan bir herpes virüsü, latanstan üretken enfeksiyona ilerlemesini desteklemek ve böylece kendisini konağın bağışıklık sisteminden korumak için komşu hücreleri işe alabilir mi? Song ve meslektaşları bu soruyu yanıtlamaya yönelik ilk adımları atıyor.










